Укажите ряд, в котором приведены формулы двух сложных и одного простого вещества:
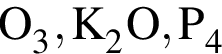
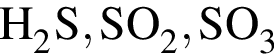
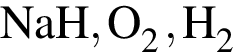
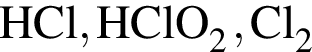
Укажите ряд, в котором приведены формулы двух сложных и одного простого вещества:
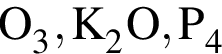
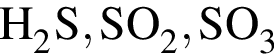
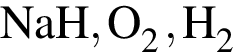
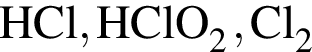
Дана электронно-графическая схема атома химического элемента в основном состоянии:
Его относительная атомная масса равна:
Согласно положению в периодической системе в порядке усиления основных свойств высших оксидов элементы расположены в ряду:
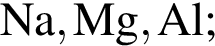
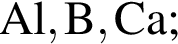
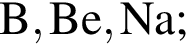
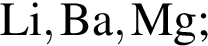
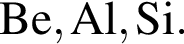
Как ковалентная полярная, так и ионная связь присутствует в веществе:
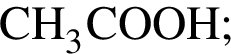
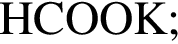
Ковалентная связь имеется во всех веществах ряда:
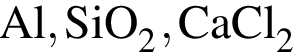
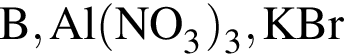
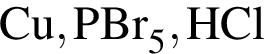
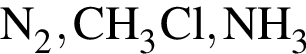
Сера проявляет высшую степень окисления в соединении:
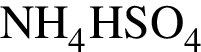 ;
;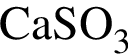 ;
;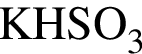 ;
;В водный раствор питьевой соды попала мраморная крошка.Удалить мрамор из смеси можно в соответствии со схемой, указанной на рисунке:
Укажите ряд химических элементов, каждый из которых образует оксид состава ![]() и гидроксид состава
и гидроксид состава 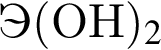 :
:
Согласно классификации оксидов несолеобразующий оксид является продуктом химического превращения:
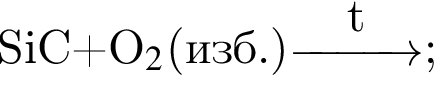
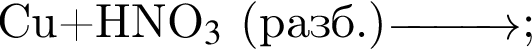
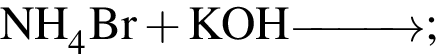
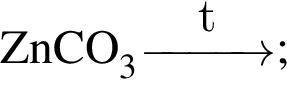
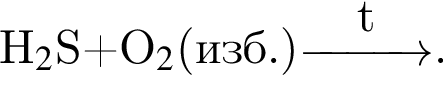
Число атомов в формульной единице соли, полученной при взаимодействии фосфорной кислоты и избытка натрия, равно:
Через колбу с избытком известковой воды пропустили смесь газов ![]()
![]()
![]() количеством по 0,01 моль каждого. На выходе из колбы обнаружили:
количеством по 0,01 моль каждого. На выходе из колбы обнаружили:
Согласно положению в периодической системе в порядке усиления неметаллических свойств элементы расположены в ряду:
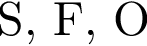
Укажите верное суждение:
На первой стадии промышленного получения серной кислоты сырьем является пирит. В уравнении соответствующей реакции коэффициент перед продуктом молекулярного строения равен:
Кислород НЕ образуется в процессе:
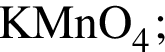
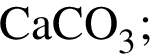
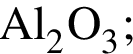
Медную стружку нагрели на воздухе до потемнения, а затем охладили и опустили в сосуд, содержащий разбавленную серную кислоту в избытке. Укажите тип реакции, протекающей в сосуде:
Труба из латуни некоторое время находилась в контакте с соляной кислотой, в результате чего подверглась химическому разрушению. Укажите тип возможной химической реакции:
Железный гвоздь погрузил в разбавленный водный раствор вещества Х. При этом масса гвоздя НЕ изменилась. Веществом Х является:
Укажите схемы процессов восстановления:
а) 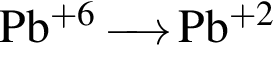
б) 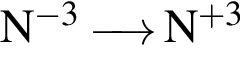
в) 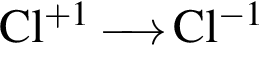
г) 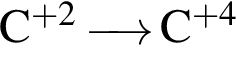
Окислительно-восстановительная реакция возможна между оксидами пары:
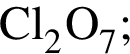
Исходное октановое число бензина, равное 100, можно увеличить добавлением:
В реакцию полимеризации вступает углеводород, модель молекулы которого указана на рисунке:
Масса (г) фосфорсодержащего продукта реакции фосфата кальция количеством 0,5 моль с фосфорной кислотой химическим количеством 2 моль при выходе 100% равна:
Правая часть сокращённого ионного уравнения имеет вид: _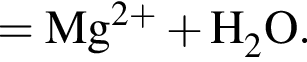 Уравнению соответствует реакция между:
Уравнению соответствует реакция между:
Установите соответствие между веществом и реактивом, который можно использовать для его качественного определения. Bce электролиты взяты в виде водных растворов.
1 — 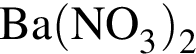
2 — 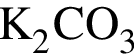
а — ![]()
б — ![]()
в — 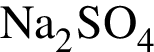
г — ![]()
Число молекул водорода, необходимого для полного гидрирования всех связей
![]() в молекуле триглицерида (см. рис.), равно:
в молекуле триглицерида (см. рис.), равно:
Молекула глюкозы в ![]() —
—
Из соединения, формула которого
индивидуальные аминокислоты можно получить в результате реакции:
При действии воды на твердое вещество А образуется углеводород Б (легче воздуха). При присоединении к Б водорода образуется углеводород В (также легче воздуха). При взаимодействии В с водой в присутствии серной кислоты образуется вещество Г. При окислении Г оксидом меди(II) при нагревании образуются органическое вещество Д, способное окисляться аммиачным раствором оксида серебра(I), и твердое вещество Е. Найдите сумму молярных масс (г/моль) веществ Б, Д и Е.
Укажите реагент, с помощью которого можно качественно отличить раствор уксусного альдегида от пропанола:
1) аммиачный раствор оксида серебра (I)
2) раствор гидроксида натрия
3) раствор хлорида железа (III)
4) раствор гидрокарбоната натрия
Алкин массой 48,15 г полностью сожгли в избытке кислорода. Образовавшийся углекислый газ смешали с гелием объемом (н. у.) 168,00 дм3. Молярная масса полученной при этом смеси газов составила 17,00 г /моль. Определите молярную массу (г/моль) алкина.
В результате полного гидролиза дипептида, образованного 2-аминопропановой кислотой, в присутствии избытка соляной кислоты получили только одно вещество — соль аминокислоты массой 37.65 г. Вычислите массу (г) дипептида, подвергшегося гидролизу.
Веществом А используется в строительстве для получения извести. При нагревании оно разлагается с образованием твердого вещества Б и не имеющего запаха газообразного вещества В, вызывающего помутнение известковой воды. При пропускании газа В через избыток раствора гидроксида бария выпадает белый осадок вещества Г. Вещество Б реагирует с водой с выделением большого количества теплоты и образованием вещества Д, раствор которого окрашивает лакмус в синий цвет. Найдите сумму молярных масс (г/моль) веществ Г и Д.
Определите молярную массу (г/моль) органического вещества Д немолекулярного строения, образующегося в результате следующих превращений:
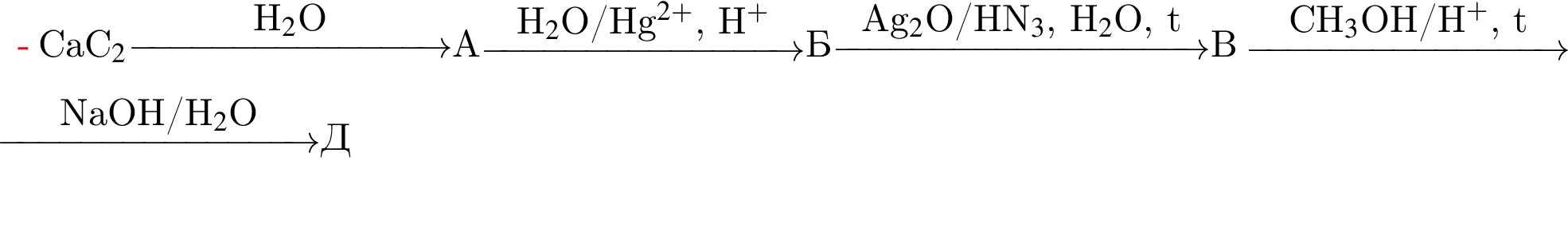
Выберите четыре утверждения, верно характеризующие фосфорную кислоту.
| 1 | бесцветная жидкость (н. у.), хорошо растворимая в воде |
| 2 | в водном растворе реагирует с фосфатом аммония |
| 3 | используется при производстве некоторых безалкогольных напитков |
| 4 | при взаимодействии 1 моль кислоты с 3 моль гидроксида натрия образуется фосфат натрия |
| 5 | сильный электролит |
| 6 | в результате электролитической диссоциации образует анионы с зарядами −1, −2 и −3 |
Ответ запишите цифрами (порядок записи цифр не имеет значения), например: 3456.
Вещество А представляет собой бесцветный газ (н. у.) с характерным резким запахом. Относительная плотность газа А по метану равна 4. В присутствии катализатора А окисляется кислородом в соединение Б, которое при растворении в воде образует сильную минеральную кислоту В. При взаимодействии А массой 9,408 г с негашеной известью Г с выходом 80% получается соль Д массой 14,112 г.
Установите соответствие между веществом, обозначенным буквой, и его молярной массой (г/моль).
А
Б
В
Г
Д
1 — 136
2 — 120
3 — 98
4 — 80
5 — 78
6 — 64
7 — 56
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А2Б1В4ГЗД5.
К раствору серной кислоты массой 140 г добавит смесь нитратов бария и свинца(II). За счет протекания реакции масса раствора увеличилась на 7,0 г, а массовые доли кислот в растворе уравнялись. Вычислите массовую долю (%) серной кислоты в исходном растворе.
Установите соответствие между схемой химической реакции, протекающей в водном растворе, и суммой коэффициентов в сокращенном ионном уравнении реакции.
А) 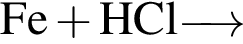
Б) 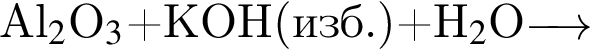
В) 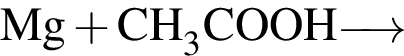
Г) 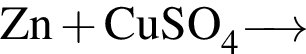
1) 3
2) 4
3) 5
4) 6
5) 7
6) 12
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А2Б3В5Г1.
В реактор постоянного объёма поместили смесь кислорода и озона химическим количеством 2 моль. В результате разложения всего озона давление в реакторе увеличилось на 15% (давление измеряли при одинаковой температуре). Вычислите объём (дм3) исходной смеси кислорода и озона (н. у.), необходимой для полного окисления
метана массой 16 г до углекислого газа и воды.
Сгорание этана протекает согласно термохимическому уравнению
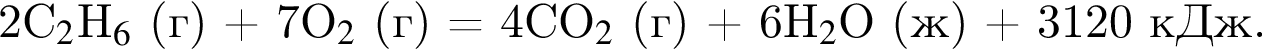
Испарение этанола протекает в соответствии с термохимическим уравнением
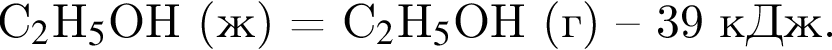
Рассчитайте минимальный объем (дм3, н. у.) этана, который необходимо сжечь для получения теплоты, достаточной для испарения этанола массой 1150 г.
Для корректировки дефицита железа в корм цыпленка бройлера добавляют кристаллогидрат соли железа в расчете 81 мг металла на 1 кг корма. Массовые доли химических элементов в кристаллогидрате составляют: 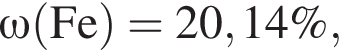
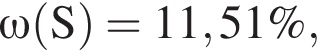
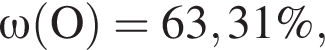
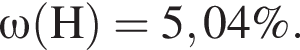 Вычислите массу (мг) кристаллогидрата в 500 г корма.
Вычислите массу (мг) кристаллогидрата в 500 г корма.
Для приготовления сахарного сиропа к порции раствора сахара массой 500 г при температуре 60 °C дополнительно добавили 220 г сахара и тщательно перемешали. При этом 20 г сахара не растворилось. Рассчитайте массу (г) сахара в исходном растворе, если его растворимость при данной температуре равна 300 г в 100 г воды.
К твердой смеси, состоящей из 48 г сульфата магния, 15,3 г мрамора и 48,3 г карбоната калия, добавили избыток дистиллированной воды и перемешали. Полученную суспензию отфильтровали, а образовавшийся на фильтре осадок высушили и взвесили. К отфильтрованному раствору добавили избыток раствора нитрата бария, в результате чего выпал новый осадок. Рассчитайте сумму масс (г) обоих осадков.
В растворе, полученном добавлением азотной кислоты к разбавленной серной кислоте, суммарная молярная концентрация анионов равна 0,006 моль/дм3, а значение pH 2. Считая, что обе кислоты полностью распадаются на ионы, вычислите количество (моль) азотной кислоты в этом растворе объемом 1 м3.